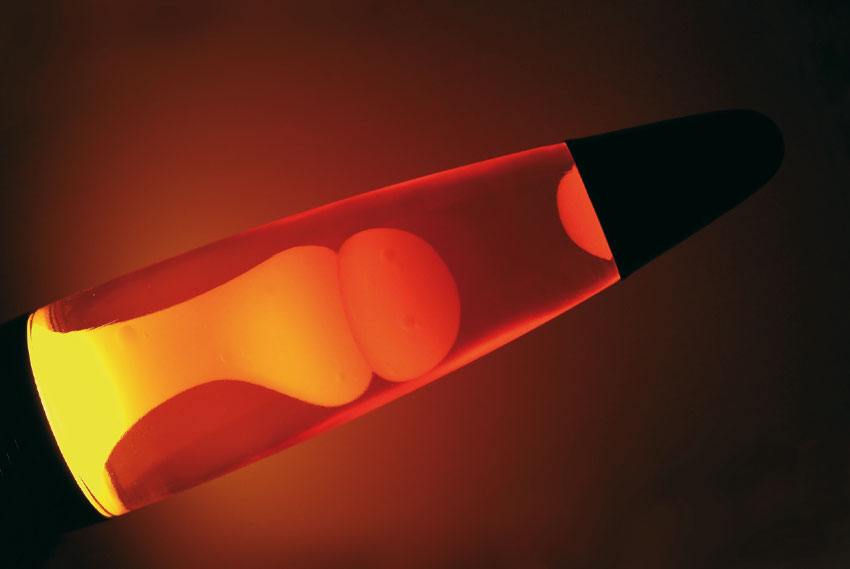
Blu, bianco e rosso: un famoso dentifricio nato negli anni ’70 affascina ancora oggi i bambini uscendo dal tubetto a strisce “immiscibili”, cioè che non si mescolano nonostante la pressione esercitata nella spremitura. Volete stupire i bambini spiegandogli come succede questa piccola magia? Come è possibile che due fluidi (come il dentifricio, che è una pasta ma è pur sempre fluido) si comportino in maniera così strana? Serve una spiegazione chimica. Il caso più banale di immiscibilità è quello di acqua e olio: se provate a mescolarli non riuscite a ottenere un “liquido unico” (in termini scientifici si dice una fase unica). Potete ottenere quella che si chiama un’emulsione, cioè tante goccioline minuscole di acqua e olio mescolate fra di loro, ma le due sostanze sono sempre distinguibili, magari con una lente o un microscopio. Se poi abbandonate un’emulsione di acqua e olio a lungo, troverete che le due sostanze si sono di nuovo separate. Tutto questo dipende dalla miscibilità, che a sua volta dipende da una proprietà delle molecole, la polarità. Più o meno tutti sanno che i protoni hanno carica elettrica positiva e stanno nel nucleo atomico, al centro, mentre gli elettroni hanno carica elettrica negativa e si trovano all’esterno del nucleo, formando una specie di “nube”. Ora, tanto per farla breve, a seconda delle caratteristiche degli atomi e delle molecole, questa “nube elettronica” si dispone in maniera diversa: di conseguenza nelle diverse parti della molecola ci sarà un po’ più o un po’ meno carica negativa. Se quest’ultima è distribuita in maniera abbastanza uniforme si dice “apolare” (che non ha polarità). Se invece la carica è distribuita in maniera non uniforme, la molecola possiede polarità: viene detta polare. Ci siamo? Adesso viene il bello. Le sostanze dotate di una polarità abbastanza simile si scioglieranno, quelle di polarità molto diversa no. L’acqua è polare (assai), l’olio d’oliva no. Nel dentifricio le strisce colorate sono spesso dei gel a base acquosa, mentre la pasta bianca, oltre ad acqua e glicerina, contiene altre sostanze che la rendono immiscibile. Se poi qualcuno di voi ha mai visto, ricevuto o regalato una “lava lamp”, avrà immaginato che le bolle sono a base oleosa e il resto del liquido a base acquosa: le bolle a bassa temperatura sono un po’ più pesanti dell’acqua, scendono in basso dove una lampadina le scalda, la loro densità diminuisce e quindi salgono, salendo si raffreddano, la densità aumenta… ormai il concetto dovrebbe essere chiaro a tutti. Naturalmente i due fluidi come detto sopra sono immiscibili e le bolle restano tali.
[Ugo Finardi – Chimico, ricercatore CNR]